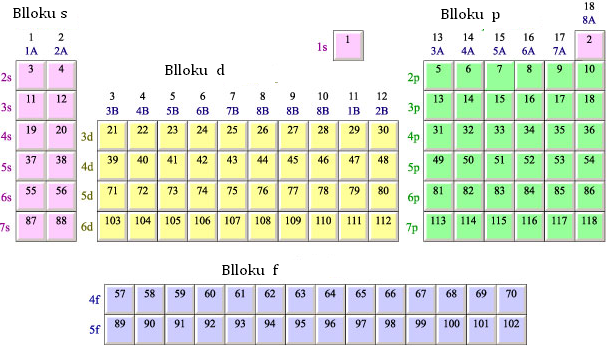
Ndёrtimi i sistemit periodik.
- Periodat nё sistemin periodik
Sistemi periodik ёshtё i ndёrtuar nga 7 rradhё horizontale qё quhen perioda. Numri i periodёs tregon se :
a) sa nivele energjitike ndodhen nё
atomin e njё elementi. (p.sh atomet
e elementeve qё ndodhen nё
periodёn
e dytё
kanё
2 nivele energjitike) b) atomet q
Periodat e vogla janё:
Perioda e parё ka dy elemente H dhe He.
Perioda e dytё ka 8 elemente, fillon me Li dhe mbaron me Ne.
Perioda e tretё ka 8 elemente, fillon me Na metal tipik alkalin dhe pёrfundon me njё gaz tё plogёt Ar.
Periodat e mёdha janё:
Perioda e katёrt ka 18 elemente.
Perioda e pestё ka 18 elemente.
Perioda e gjashtё ka 32 elemente.
Perioda e shtatё ёshtё e paplotёsuar.Ajo ka afёrsisht 17 elemente
Çdo periodё ( pёrjashtim bёn perioda e parё) fillon me njё metal alkalin dhe mbaron me njё gaz tё plogёt (tё rallё).
- Grupet nё sistemin periodik
Pёrveç radhёve horizontale nё sistemin periodik kemi dhe kolonat vertikale gjithsej 18, tё cilat shёnohen dhe me numra arabё nga 1-18. Kёto kolona formojnё 16 grupe. Grupet shёnohen me gёrma A dhe B. Kemi 8 grupe A dhe 8 grupe B.
Numri i grupit i shoqёruar me gёrmёn A tregon:
- Numrin e elektroneve qё ndodhen nё nivelin e jashtёm
- Numrin e elektroneve valentore
Valencёn maksimale tё elementeve nё lidhje me oksigjenin me pak pёrjashtime, si oksigjeni , i cili ka valencёn 2 dhe fluori (F) i cili ka valencёn 1.
Grupi IA- metale alkalinё
Grupi IIA metale alkalino tokёsorё
Grupi VIIA- halogjenet
Grupi VIIIA- gazet e plogёt (e rrallë)
-
Numri i grupit i shoqёruar me gёrmёn B tregon:
- Numrin e elektroneve valentore
- Valencёn maksimale tё elementeve nё lidhje me oksigjenin me pёrjashtim tё grupit IB, ku valenca maksimale e elementeve ёshtё III. Elementet e grupeve B kanё nё pёrgjithёsi dy elektrone nё nivelin e jashtёm.Numri i elektroneve valentore nё kёto elemente plotёsohet me elektrone tё nёnnivelit d.
Nё fund tё sistemit periodik vendosen dy rradhё horizontale me nga 14 elemente secila .Ato pёrfaqёsojnё dy familje tё mёdha
Lantanidet (tё ngjashme me lantanin)
Aktinidet ( tё ngjashme me aktinin)
- Blloqet e elementeve nё sistemin periodik
Elementёt e sistemit peridik ndodhen nё 4 blloqe
- Blloku i elementeve s.
Kёto elemente plotёsojnё nёnnivelin s tё nivelit tё jashtёm nga 1-2e-. Kёtu hyjnё elementёt e grupeve IA ─ IIA.
- Blloku i elementeve p.
Kёto elemente plotёsojnё nёnnivelin p tё nivelit tё jashtёm nga 1-6e-. Kёtu hyjnё elementёt e grupeve IIIA─ VIIIA
- Blloku i elementeve d.
Kёto elemente plotёsojnё nёnnivelin d tё nivelit tё parafundit ( i dyti nga jashtё) nga 1-10e-. Kёtu hyjnё elementёt e grupeve IB─VIIIB
- Blloku i elementeve f.
Kёto elemente plotёsojnё nёnnivelin f (tё nivelit tё tretё duke u nisur nga jashtё) nga 1-14e-. Kёtu hyjnё dy familjet e mёdha, lantanidet dhe aktinidet
Metalet dhe jometalet
Nё sistemin periodik elementet klasifikohen nё metalet, jometalet dhe gazet e plogёta. Ky lloj klasifikimi bazohet nё vetitё fizike dhe kimike tё tyre.
Veçoritё e metaleve
Nё sistemin periodik metalet gjenden nё tё majtё tё vijёs zigzake, ku bёjnё pjesё elementёt e grupeve IA, IIA, IIIA, IB-VIIIB dhe njё pjesё e elementeve p.
- Kanё pak elektrone nё nivelin e jashtёm 1- 3e-.
- I lёshojnё me lehtёsi elektronet e nivelit tё jashtёm dhe formojnё katione (jone me ngarkesё pozitive).
- Metalet karakterizohen nga rreze tё mёdha, Jonet e tyre kanё rreze pak mё tё vogёl se atomet e tyre nё gjendje themelore.
- Pёrcjellin rrymёn elektrike pёr shkak tё pranisё sё elektroneve tё lira.
- Kanё energji jonizimi me vlera tё ulta.
- Veprojnё me oksigjenin japin okside bazike , tё cilat nё kushte tё zakonshme janё nё gjendje tё ngurtё.
Veçoritё e jometaleve
Nё sistemin periodik jometalet gjenden nё tё djathtё tё vijёs zigzake, deri tek grupi VIII A
- Kanё shumё elektrone nё nivelin e jashtёm 5- 7e-.
- Marrin elektrone pёr tё plotёsuar nivelin e jashtёm me 8e- dhe formojnё anione (jone me ngarkesё negative).
- Jometalet karakterizohen nga rreze tё vogla, Jonet e tyre kanё rreze pak mё tё madhe se atomet e tyre nё gjendje themelore.
- Nuk pёrcjellin as rrymёn elektrike, as nxehtёsinё, sepse nuk kanё elektroneve tё lira.
- Kanё energji jonizimi me vlera tё larta
- Veprojnё me oksigjenin japin okside acide, tё cilat nё kushte tё zakonshme janё nё gjendje tё gaztё.
 Rrezja
atomike, ndryshimi i saj nё sistemin periodik
Rrezja
atomike, ndryshimi i saj nё sistemin periodik
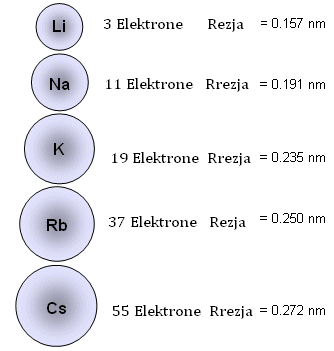
Elementёt e tё njёjtit grup kanё veti fizike dhe kimike tё ngjashme, tё cilat mund tё pёrgjithёsohen dhe tё pёrfaqёsojnё karakteristikat e grupit. Kёto veti themi se janё tё ngjashme, por jo tё njёjta, sepse atomet e elementeve qё gjenden nё tё njёjtin grup ndryshojnё njeri nga tjetri nga numri i niveleve energjitike. Nёse paraqesim atomet e elementeve me forma sferike , mund tё kemi sfera me pёrmasa tё ndryshme p.sh:
Vihet re , se duke kaluar nga nga Li tek Cs, vёllimi i atomit rritet pёr shkak tё rritjes sё numrit tё niveleve energjitke. Vёllimi i atomit varet nga madhёsia e rrezes sё tij.
Largёsia nga bёrthama deri tek orbitali mё i jashtёm i njё atomi do tё quhet rreze atomike.
Nё sistemin periodik brenda njё periode, kur kalojmё nga e majta nё tё djathtё rrezja zvogёlohet. Nё sistemin periodik brenda grupeve A, rrezja rritet duke kaluar nga lart- poshtё.
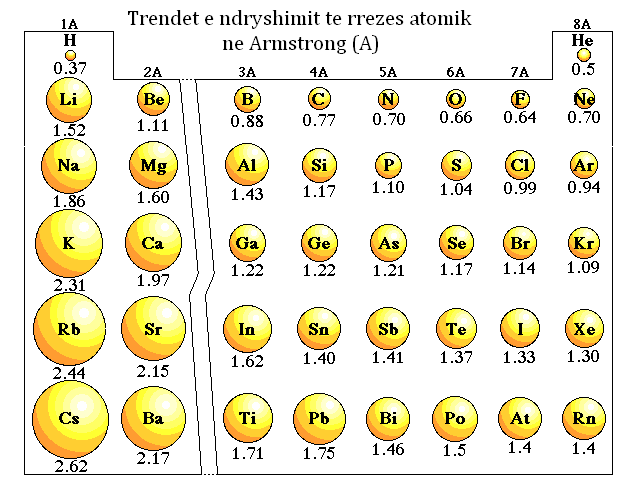
Nё grupet B rrezja rritet duke kaluar nga elementet e periodёs sё katёrt nё elementet e periodёs sё pestё. Kur kalojmё nga elementet e periodёs sё pestё nё elementet e periodёs sё gjashtё, rrezja pothuajse nuk ndryshon.
Potenciali e jonizimit
Nё njё atom, çdo elektron tёrhiqet nga ngarkesa pozitive tё bёrthamёs me anё tё forcave tё tёrheqjes elektrostatike. Nё rast se nga atomi i njё elementi duam tё largojmё njё ose disa elektrone (pёr ta kthyer nё kation) ёshtё e nevojshme tё mposhtim forcat e tёrheqjes bёrthamё-elektron. Nё kёtё rast, atomit i nevojitet njё sasi energjie e barabartё me sasinё e energjisё me tё cilёn bёrthama tёrheq elektronin.
Sasia e energjisё, e cila i nevojitet atomit pёr shkёputjen e elektronit qё ndodhet nё orbitalin mё tё jashtёm tё tij, quhet energji e jonizimit dhe shkruhet me gёrmёn I.
Nё rast se nga atomi i njё elementi duhet tё largohen dy ose mё shumё elektrone, energjia e jonizimit ёshtё e barabartё me shumёn e energjive qё i jepen atomit pёr tё larguar me rradhё elektronet. Sa mё larg tё jetё elektroni nga bёrthama, aq mё e vogёl ёshtё sasia e energjisё qё i jepet atomit pёr shkёputjen e tij. Vlera e energjisё sё jonizimit ёshtё e lidhur me madhёsinё e rrezes.
Sa mё e vogёl tё jetё rrezja e atomit, aq mё e madhe ёshtё vlera e potencialit tё jonizimit dhe anasjelltas, sa mё e madhe tё jetё rrezja e atomit, aq mё e vogёl ёshtё vlera e potencialit tё jonizimit. Metalet kanё vlera tё ulta tё potencialit tё jonizimit, sepse karakterizohen nga rreze tё mёdha dhe numёr tё vogёl elektronesh nё shtresёn e jashtme. Jometalet kanё vlera tё larta tё potencialit tё jonizimit, sepse karakterizohen nga rreze tё vogla dhe numёr tё madh elektronesh nё shtresёn e jashtme.
Nё pёrgjithёsi shkruajmё: A ne-→An+ kation ( A simboli i atomit)
Metalet japin elektrone, pёr vete oksidohen, ndёrsa pёr elementёt e tjerё sillen si reduktues.
Si ndryshon vlera e potencialit tё jonizimit, nё perioda dhe nё grupe, nё sistemin periodik?
Duke kaluar brenda njё periode, nga e majta nё tё djathtё, rrezja atomike zvogёlohet, vlera e energjisё sё jonizimit rritet.
Ndёrsa nё grupe, duke kaluar nga lartё -poshtё, rrezja atomike rritet, vlera e energjisё sё jonizimit zvogёlohet.
Elektronegativiteti
Pёr tё pёrcaktuar karakterin e elementit, d.m.th., aftёsinё e tij pёr tё marrё ose pёr tё dhёnё elektrone, pёr tё tёrhequr ose shtytur çifte elektronike, na vjen nё ndihmё koncepti i elektronegativitetit.
Elektronegativiteti i njё elementi, nё njё pёrbёrje kimike, pёrcaktohet si prirja qё ka atomi i tij pёr tё tёrhequr elektronet e lidhjes.
Nё molekulёn e klorurit tё hidrogjenit HCl, tё dyja atomet lidhen midis tyre me anёn e njё çifti elektronik, i cili ёshtё i pёrbashkёt. Ky çift tёrhiqet mё shumё nga klori sesa nga hidrogjeni. Hidrogjeni ёshtё element elektropozitiv, kurse klori ёshtё element elektronegativ.
Elektronegativiteti i njё elementi njehsohet duke mbledhur vlerёn e potencialit tё jonizimit me atё tё energjisё sё afёrisё pёr elektronin. EN = I +A.
Elektronegativiteti ёshtё nё pёrpjestim tё zhdrejtё me rrezen,
Nё sistemin periodik kur kalojmё nё periodё nga majta nё tё djathtё rrezja zvogёlohet, vlera e EN rritet. Nё grupe duke kaluar nga lart-poshtё rrezja rritet, vlera e EN zvogёlohet.
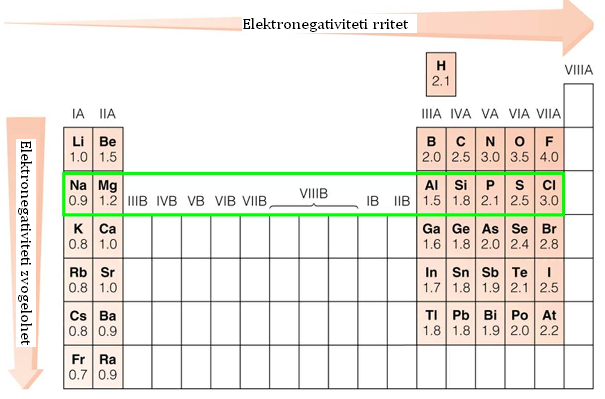
Metalet kanё vlerё tё ulёt tё EN, kurse jometalet kanё vlerё tё lartё tё EN.
Vlera e EN mund tё jetё 0 < EN < 4.
Nё sistemin periodik fluori (F) ёshtё elementi mё elektronegatv, ndёrsa franciumi (Fr) ёshtё elementi mё elektropozitiv.